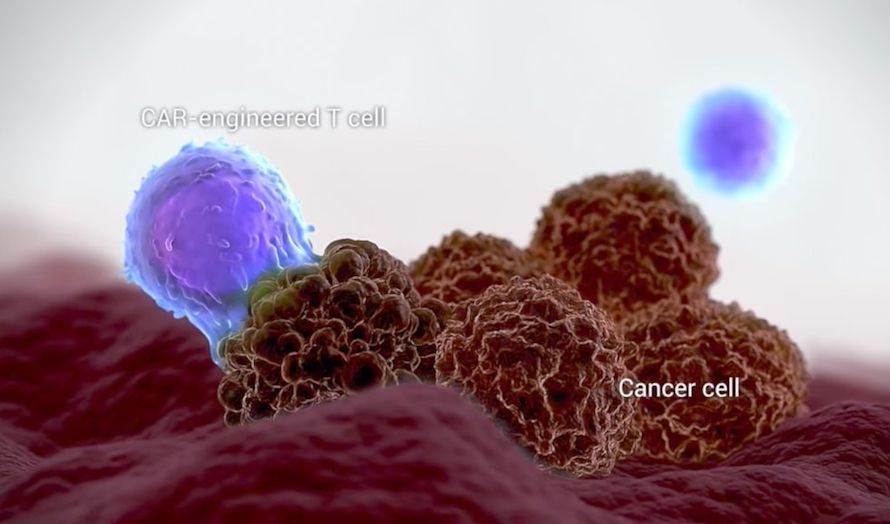
Amerikanske myndigheter har godkjent en ny israelsk behandling for lymfekreft. Det er andre gang en slik type behandling er blitt godkjent, og den kan revolusjonere måten man behandler kreft på, skriver den israelske avisen Jerusalem Post.
– Dette starter et nytt vitenskapelig paradigme for behandling av alvorlige sykdommer. I løpet av bare noen få tiår har genterapi gått fra å være et lovende konsept til en praktisk løsning på dødelige og stort sett uhelbredelige former for kreft, sier Scott Gottlieb i det amerikanske Food and Drug Administration (FDA) i en pressemelding til flere internasjonale medier.
Medisinen, som heter Yescarta, er utviklet av det israelske selskapet Kite Pharma. Det er ventet at medisinen vil koste rundt tre millioner kroner i USA, noe som vil genere inntekter på flere hundre millioner amerikanske dollar. I august ble det israelske selskapet kjøpt opp av Gilead Sciences til en pris av 95 milliarder kroner.
Selv om prisen på behandlingen kan virke høy, er den lavere enn sammenlignbare behandlinger. Det som skiller den israelske behandlingen ut fra andre, er at hver dose av medisinen er personlig tilpasset. Medisinen tar i bruk pasientens eget immunforsvar til å angripe lymfekreften.
Behandlingen ble først utviklet av National Cancer Institute og doktor Steven Rosenberg. De signerte en avtale med Kite Pharma i 2012, hvor Kite bidro til å finansiere forskningen mot patentrettigheter på kreftbehandlingen.
Yescarta er den andre genbehandlingen som blir godkjent av FDA og den første som behandler non-Hodgkins lymfom, eller voksne som lider av B-celle lymfom.
Det nye legemiddelet vil hjelpe pasienter hvor to innledende behandlinger har feilet. Behandlingsresultatet ved bruk av Yescarta er på 51 prosent. Det er mye høyere enn sammenlignbare kliniske studier. Men den kan også ha livsfarlige bivirkninger.
– Godkjennelsen av Yescarta bringer denne nyskapende CAR-T-celleterapi til en ekstra gruppe kreftpasienter med få andre alternativer. Voksne mennesker med visse typer lymfom hvor behandling ikke har hjulpet tidligere, sier Peter Marks, direktør for FDAs senter for biologisk evaluering og forskning i pressemeldingen.